Schon bald nach der Geburt besiedeln Bakterien unsere Haut, unseren Darm und unsere Mundhöhle. Diese oralen Bakteriengemeinschaften, das Mikrobiom, umfassen rund 1000 verschiedene Arten und sind hochkomplex. Das orale Mikrobiom ist nach dem Dickdarm die zweitkomplexeste bakterielle Gemeinschaft im Körper. Das orale Mikrobiom wird sowohl mit oralen Erkrankungen wie Karies, endodontischen (altgriechisch ἔνδον endon „innen“, ὀδών odon „Zahn“, λόγος logos „Lehre“ – die Lehre vom Zahninneren) Infektionen, Gingivitis und Parodontitis als auch mit nicht oralen Erkrankungen in Verbindung gebracht. Es gibt weitere Belege dafür, dass das orale Mikrobiom nicht nur bei Krankheiten, sondern auch für die menschliche Gesundheit eine wichtige Rolle spielt, unter anderem bei der Immunreaktion, dem Stoffwechsel und der Nährstoffverdauung. Grundlagen über unser orales Mikrobiom findet ihr hier: https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC6503789/
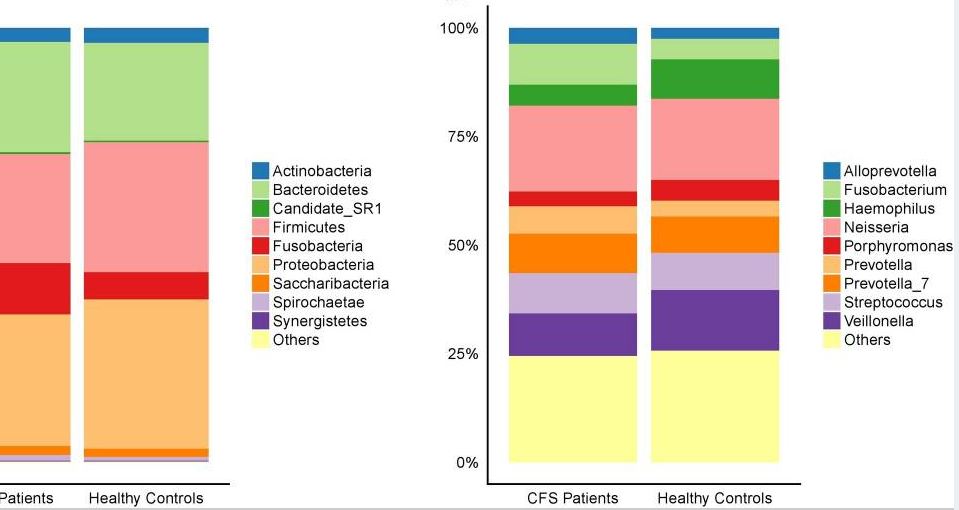
Die Zusammensetzung unseres Mikrobiom hängt stark von unserem Lebensstil, unserer Ernährung etc. zusammen. Die funktionelle Analyse (in der hier vorgestellten Studie) der abgeleiteten Metagenome zeigte, dass die bei CFS-Patienten veränderten Bakteriengattungen in erster Linie mit dem Aminosäure- und Energiestoffwechsel in Verbindung stehen. Ferner zeigten die Ergebnisse, dass sich das orale Mikrobiom von CFS-Patienten von dem gesunder Kontrollpersonen unterscheidet, und dass diese Unterschiede zu Verschiebungen in den Funktionswegen führen, die Auswirkungen auf die Pathogenese des CFS haben.
Bakterien, Pilze und Viren gelangen durch unseren Mund weiter in unserem Körper und die meisten werden durch unsere Magensäure neutralisiert. Ist unser orales Mikrobiom z. B. mit vermehrten Keimzahlen von Porphyromonas gingivalis und Aggregatibacter actionmycetemcomitans belastet, steigt die Wahrscheinlichkeit, dass diese auch mal nicht durch die Magensäure eliminiert. Porphyromonas gingivalis und Aggregatibacter actionmycetemcomitans, werden mit einem erhöhten Risiko für Bauchspeicheldrüsenkrebs in Verbindung gebracht. Immer wiederkehrende Helicobacter Infektionen stehen im Zusammenhang mit einer oralen Infektion durch diesen Keim. https://www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC4716065/
Nachfolgend der Link zu der Volltext Studie: Chronic fatigue syndrome patients have alterations in their oral microbiome composition and function (nih.gov)
Unser Speichel im Mund besteht zu ca. 99 % aus Wasser und sein ph-Wert variiert von 6,5 – 7,2, was als relativ neutral gilt. Wir haben im unseren Mund verschiedene Speicheldrüsen um unsere Nahrung einzuspeicheln, damit wir sie besser herunterschlucken können. Außerdem enthält unser Speichel Verdauungsenzyme, die Alpha-Amylase (wird benötigt um Kohlenhydrate zu verdauen) und Bakterizide (Lysozym / Lactoferrin). Weitere Bestandteile in unserem Speichel sind Opiorphin (3 – 6fach stärker als Morphin), Immunglobuline, Muzine (Glycoproteine) und Bikarbonat (sorgt für ein basisches Milieu). Nach jeder Mahlzeit wird mehr Speichel produziert und er wird somit basischer. Eine kohlenhydratreiche Kost (vor allem Zucker) führt eher zu einem sauren Milieu im Mund als proteinreiche Nahrung. Der optimale ph-Wert liegt bei > 6,7, weil unsere Zähne sonst entmineralisiert werden. Bei einem ph-Wert ab 5,5 wird unser Zahnschmelz bereits angriffen. Der ph-Wert von unserem Stuhl sollte zwischen 5,5 und 6,5 liegen. Unser ph-Wert im Blut wird in engeren Grenzen und zwar zwischen 7,35 – 7,45 gehalten. Hierzu haben wir verschiedene Puffersysteme (Phosphat-Puffer, Bicarbonat-Puffer, Hämoglobin-Puffer) um einen optimalen ph-Wert zu gewährleisten.
Mit ph-Wertmessstreifen (Indikatorpapier) kann man den ph-Wert messen. Hier bieten sich die Teststreifen an, die man nimmt um den ph-Wert des Urins zu bestimmen. Um genaue Messergebnisse zu erhalten sollte man 2 Stunden vor dem Messen nichts mehr Essen. Unsere Salzsäure (HCl) wird von den Belegzellen (Parietalzellen) gebildet und bei der Produktion entsteht Bicarbonat (HCO3). Werden unsere empfindlichen Belegzellen z. B. durch Endotoxine (Lipopolysaccharide (LPS)) geschwächt, dann entsteht auch weniger Bicarbonat (Bicarbonat-Puffer). Um zu schauen, wie gut unsere Puffer sind, kann man nach dem Messen den Mund mit Zitronensaft spülen. Die Messung kann man danach in zweiminutigen Zeitabständen wiederholen (ohne nochmalig zu Spülen). Der ph-Wert sollte innerhalb von 10 Minuten wieder auf > 7 ansteigen.
Eine Kombination aus hochdosierter rechtsdrehender Milchsäure (L-(+)-Milchsäure), löslichen Ballaststoffen und basischen Citraten und ggf. Probiotika können hilfreich sein um den ph-Wert im Mund zu erhöhen. Die Fähigkeit zur Kompensation säurebedingter pH-Wert-Schwankungen ist ein wichtiger Indikator für unsere orale Gesundheit sowie für unser Mikrobiom. Streptococcus dentisani, das die Forscher aus kariesfreien Personen isolierten, hilft, Krankheitserreger im Mund abzutöten. Aber auch Streptococcus salivarius und Lactobacillus reuteri können kariesfördernde Bakterien verdrängen und beugen Parodontalerkrankungen vor, wie Gingivitis (Zahnfleischentzündung) und Plaque. Ein Präparat mit Streptococcus dentisani scheint es (noch) nicht zu geben. Zu dem beiden letztgenannten Bakterien findet man einige Präparate.
Migräne korreliert mit höheren Konzentrationen von Nitrat-, Nitrit- und Stickoxid-reduzierenden oralen Mikroben in der American Gut Project-Kohorte
ABSTRACT
Nitrate, wie z. B. Herztherapeutika und Lebensmittelzusatzstoffe, sind häufige Auslöser von Kopfschmerzen, wobei Stickstoffmonoxid eine wichtige Rolle spielt. Fakultativ anaerobe Bakterien in der Mundhöhle können über den Nitrat-Nitrit-Stickoxid-Weg im Speichel migräneauslösende Mengen an Stickstoffmonoxid produzieren. Mit Hilfe von Hochdurchsatz-Sequenzierungstechnologien konnten wir in Proben aus der Mundhöhle von Migränepatienten im Vergleich zu Nicht-Migränepatienten eine signifikant höhere Abundanz von Nitrat-, Nitrit- und Stickoxid-Reduktase-Genen nachweisen und einen leichten, aber signifikanten Unterschied in Stuhlproben.
vgl. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5080405/
Studie zu Parodontitis: https://www.mdpi.com/2072-6643/14/12/2426/htm
Studien zu dem oralen Mikrobiom und COVID-19:
https://www.nature.com/articles/s41522-021-00232-5
https://www.frontiersin.org/articles/10.3389/fmicb.2021.687513/full