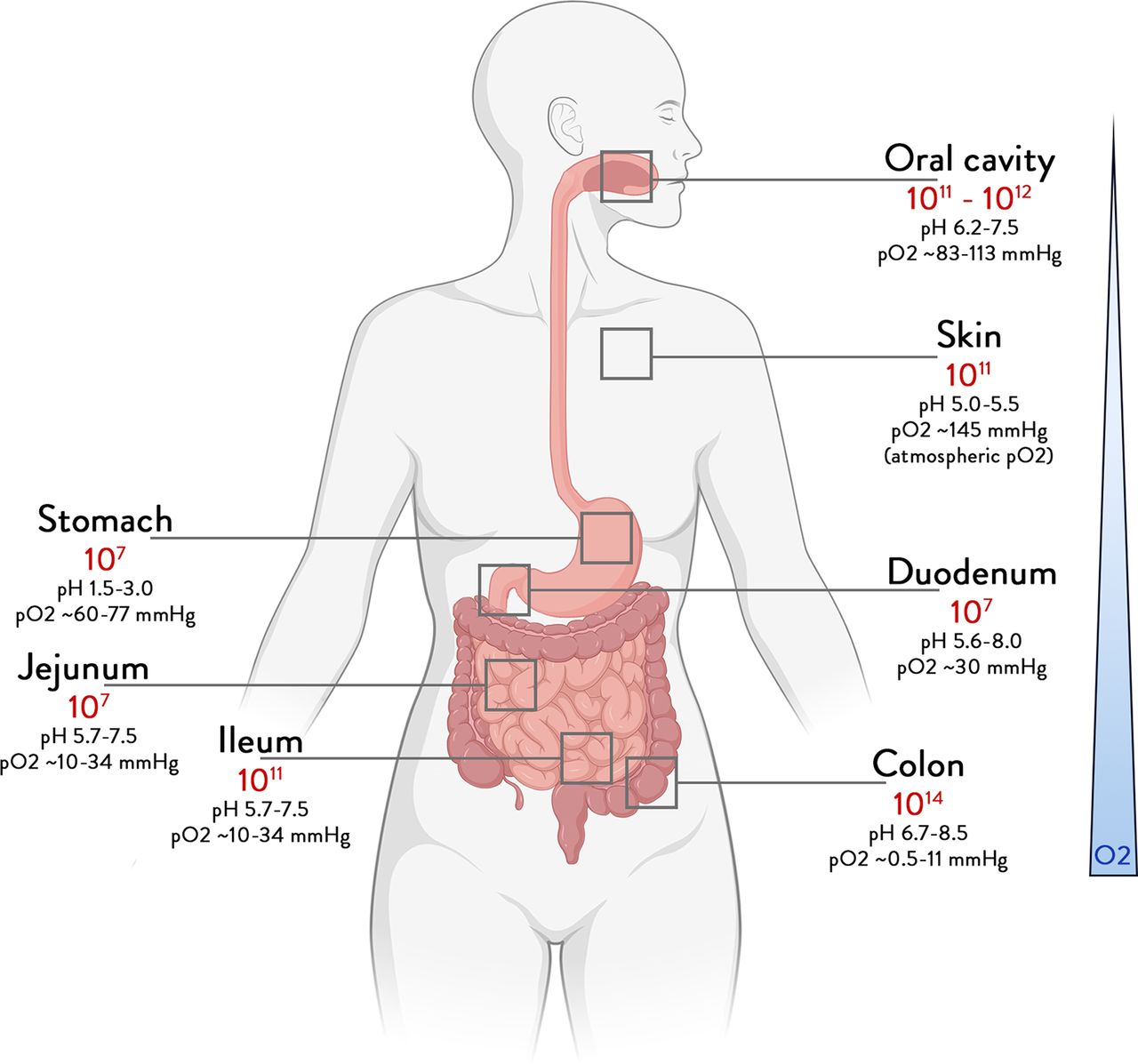
Das menschliche Mikrobiom wird hier als die Gesamtheit der Mikroben, ihrer Gene und ihrer Produkte betrachtet, die unseren Körper von Geburt an besiedeln und vertikal übertragen werden. Zwar sind alle Körperstellen besiedelt (Abbildung), doch die höchste Mikrobenanzahl findet sich im Darm, der umfassend untersucht wurde. Im Folgenden werden die wichtigsten und neuesten Erkenntnisse zusammengefasst, die sich mit der Art und Weise befassen, wie Darmmikroben, ihre Aktivitäten und Botenstoffe zu unserer Gesundheit beitragen können.
Bei gesunden Menschen enthält das orale Mikrobiom und das Speichelmikrobiom Millionen von Mikroben, die täglich mit der Nahrung verschluckt werden. Ihre Persistenz im Darm wird jedoch durch viele Faktoren behindert, darunter der Säuregehalt des Magens, die Produktion von Gallensäuren, Verdauungsenzymen und antimikrobiellen Proteinen im Zwölffingerdarm und darüber hinaus. Eine große Anzahl anderer wichtiger Variablen beeinflusst die weitere mikrobielle Besiedlung, wie chemische Parameter wie pH-Wert, Sauerstoffkonzentration und Redoxpotential, die biologische Produktion von Schleim, Galle und Antikörpern sowie physikalische Aspekte wie Darmarchitektur, Peristaltik und Transitzeiten (Abbildung). Im Dünndarm ist ein Konzentrationsgradient von Mikroben zu beobachten, da die mikrobielle Abundanz in Zwölffingerdarmaspiraten um das 1000-fache geringer ist als in oralen Proben, obwohl sie aus ähnlichen mikrobiellen Taxa bestehen. Folglich enthält der Dünndarm eine zunehmende Anzahl von Tausenden bis zu mehreren Hundert Millionen Zellen pro Gramm Inhalt mit teilweise sauerstofftoleranten Firmicutes und Proteobakterien als Hauptphyla. Dies alles kulminiert im unteren Darm, wo sich Höchstgemeinschaften von bis zu 100 Milliarden Zellen pro Gramm für bis zu einige Tage aufhalten, da die Transitzeit im Dickdarm mehr als ein Dutzend Mal länger ist als im Dünndarm. Daher wird das Mikrobiom des Dickdarms von hauptsächlich anaeroben Bakterien dominiert, die Tausende von Arten und Millionen von Genen umfassen, die sich auf die Hauptgruppen der Firmicutes (vor allem Ruminococcaceae und Lachnospiraceae), Bacteroidetes, Actinobacteria, Proteobacteria und Verrucomicrobia (Akkermansia) verteilen (Abbildung). Diese mit den Fäkalien ausgeschiedene Biomasse bildet das so genannte Darmmikrobiom, das mit einer Vielzahl von Krankheiten in Verbindung gebracht wird und durch Ernährung und Medikamente in hohem Maße veränderbar ist. Es liefert das Ausgangsmaterial für die fäkale Mikrobiota-Transplantation (FMT / Stuhltransplantation), die nachweislich Patienten mit rezidivierenden Clostridioides-difficile-Infektionen und anderen Krankheiten heilen kann.
Es ist wichtig festzustellen, dass wir ohne Dickdarm leben können, aber nicht ohne den Dünndarm, der die größten Schleimhautoberflächen unseres Körpers aufweist, wo unsere Nahrung weiter verdaut und aufgenommen wird, die meisten Darmrezeptoren, Immun- und Nervenzellen enthält und zunehmend in den wichtigen Mikroben-Wirt-Übergang involviert ist. In den letzten Jahren wurde eine Reihe neuer Technologien entwickelt, die zwar experimentell schwer zugänglich sind, aber Katheter oder Kapseln zur Probenahme, Verabreichung oder Inspektion umfassen. Darüber hinaus wurde Dünndarmausfluss aus Ileostomien (künstlicher Ausgang des Dünndarms) untersucht und festgestellt, dass er bis zu 100 Millionen Mikroben pro Gramm Nassgewicht enthält, die personalisierte Gemeinschaften bilden und Tag- und Nachtrhythmen aufweisen, die die Nahrungsaufnahme und -verarbeitung widerspiegeln. Funktionelle (Transkriptomik (Unter dem Begriff der Transkriptomik versteht man die Studie der mRNA-Expression einer Zelle.) und gezielte Metabolomik (Die Metabolomik (engl. metabolomics) befasst sich mit der Erforschung sämtlicher Stoffwechselprodukte und -eigenschaften (Metabolom) von Zellen und Geweben.)) und metagenomische Analysen solcher Proben ergaben, dass die kolonisierenden Streptococcus und Lactobacillus spp. ein großes Reservoir an hocheffektiven Transportsystemen exprimieren, die mit dem Wirt um die Aufnahme und Verwendung von Zucker konkurrieren und Laktat und Acetat erzeugen, die Substrate für Veillonella spp. sind und dann in Propionat umgewandelt werden. Jüngste Studien unter Verwendung speziell entwickelter Katheter bestätigten diese Gemeinschaften und zeigten, dass die Mikrobiota im Zwölffingerdarm eine höhere Dynamik in der Zusammensetzung aufweist, die mit dem pH-Wert korreliert, als im Jejunum, dem Darmkompartiment (Darmabschnitt) mit der größten Oberfläche, das für den größten Teil der Zucker-, Protein- und Lipidverdauung und -absorption verantwortlich ist. Während es ein Kontinuum zwischen dem Duodenum und dem Jejunum gibt, weist das proximalere Ileum eine große Schleimschicht auf, die an den Dickdarm erinnert, und ist mit mehreren Anaerobiern besiedelt, darunter Mitglieder der Bacteroidia, Ruminococcaceae und Lachnospiraceae, von denen einige auch an der Umwandlung von BAs beteiligt sind (siehe Abschnitt Bioaktive Lipide/Bilsäuren).
Der Zwölffingerdarm und seine Mikroben haben sich als wichtiger Faktor bei einer Reihe von Stoffwechsel- und möglicherweise auch Immunkrankheiten erwiesen. Dies und weitere neue Erkenntnisse wurden durch die duodenale Verabreichung von FMT bestätigt, die die Symptome des metabolischen Syndroms oder von Autoimmunkrankheiten linderte. Darüber hinaus wurde festgestellt, dass duodenale Perfusionen von lebenden oder toten Lactobacillus spp. die Immunreaktion des Wirts beeinflussen und somit ein experimentelles System für die Entdeckung beim Menschen darstellen. Dies wurde kürzlich für die Analyse einer einzigen duodenalen Dosis von Anaerobutyricum soehngenii (früher bekannt als Eubacterium hallii) genutzt, die die duodenale Expression des Gens für das regenerierende Inselprotein 1B fast um das Zehnfache erhöhte und auch das Serum von glucagon-ähnlichem Peptid-1 (GLP-1) und sekundären Gallensalzen bei Personen mit metabolischem Syndrom ansteigen ließ, was möglicherweise ihre verbesserte Reaktion auf Glukose erklärt.
Obwohl es im Darm einen offensichtlichen vertikalen Gradienten gibt, existiert auch ein horizontaler Gradient, der am ausführlichsten im Dickdarm untersucht wurde. Wichtig ist, dass es Sauerstoff-, Redox- und Schleimgradienten gibt, die an der Schleimhautoberfläche beginnen und sich bis zum Lumen ausdehnen, was zu einer Architektur der mikrobiellen Gemeinschaften führt. Grob gesagt beginnen diese mit schleimabbauenden Konsortien, die in der Regel von der mukolytischen und mikroaerophilen Akkermansia muciniphila dominiert werden, und enden mit streng anaeroben Gemeinschaften, zu denen Butyrat- und Propionat-produzierende Ruminococcaceae, Lachnospiraceae und Bacteroidia sowie Homoacetogene und Methanogene gehören, die Wasserstoff und Kohlendioxid in Acetat bzw. Methan umwandeln.
Das Darmmikrobiom und verschiedene intestinale und extraintestinale Erkrankungen
Das Darmmikrobiom wird mit verschiedenen intestinalen und extraintestinalen Erkrankungen in Verbindung gebracht. Viele große Studien, die das Darmmikrobiom und seine Bedeutung untersuchen, wurden bei spezifischen gastrointestinalen Erkrankungen durchgeführt, wie z. B. bei Darmerkrankungen (IBD), Zöliakie, Reizdarmsyndrom (IBS), Dickdarmkrebs (CRC), chronischen Lebererkrankungen oder Bauchspeicheldrüsenerkrankungen. CED, prototypische entzündliche Darmerkrankungen, werden mit einer abweichenden Zusammensetzung des Darmmikrobioms in Verbindung gebracht, und in der Tat wurde über fakultative Anaerobier berichtet, insbesondere im Zusammenhang mit aktiven Entzündungen und Stoffwechselstörungen, einschließlich BAs, kurzkettigen Fettsäuren (SCFAs) und Acylcarnitin-Stoffwechsel. Längsschnittanalysen bei Säuglingen mit Zöliakie-Risiko, einer anderen häufigen entzündlichen Darmerkrankung, zeigten ein erhöhtes Vorkommen verschiedener Mikrobenarten wie Dialister invisus, Parabacteroides spp oder Lachnospiraceae und bestimmter Metaboliten wie Tryptophanmetaboliten vor Ausbruch der Krankheit, während verschiedene entzündungshemmende Stämme wie Faecalibacterium prausnitzii oder Clostridium clostridioforme vermindert waren. Das Reizdarmsyndrom (IBS), eine häufige Funktionsstörung des Magen-Darm-Trakts, wurde mit subtypspezifischen Veränderungen des Darmmikrobioms und damit verbundener Stoffwechselprodukte in Verbindung gebracht, wobei der Purinstoffwechsel besonders betroffen ist. Darmkrebs (CRC), die häufigste bösartige Erkrankung im unteren Darmbereich, wurde überzeugend mit einem gestörten Darmmikrobiom in Verbindung gebracht, wobei bestimmte Bakterien wie Fusobacterium nucleatum, Escherichia coli oder Bacteroides fragilis beteiligt waren, von denen einige aus dem oralen Mikrobiom stammen. Chronische Lebererkrankungen, insbesondere fortgeschrittene Lebererkrankungen wie Leberzirrhose, sind durch tiefgreifende mikrobielle Aberrationen gekennzeichnet, und Daten aus Interventionsstudien mit Präbiotika, Probiotika und Antibiotika haben eindeutig belegt, dass das Darmmikrobiom bei diesen Erkrankungen eine Schlüsselrolle spielt. Das Adenokarzinom der Bauchspeicheldrüse, eine in der westlichen Welt zunehmend anerkannte bösartige Erkrankung, wurde ebenfalls mit einem beeinträchtigten Darmmikrobiom in Verbindung gebracht, da die Zusammensetzung des intratumoralen Mikrobioms die Immunantwort des Wirts und den natürlichen Verlauf der Erkrankung beeinflusst.
Das Darmmikrobiom wurde in den letzten Jahren bei Adipositas und mit Adipositas zusammenhängenden Erkrankungen wie Typ-2-Diabetes (T2D) und nichtalkoholischer Fettlebererkrankung (NAFLD) eingehend untersucht. Viele Studien haben versucht, ein verändertes Darmmikrobiom mit Fettleibigkeit in Verbindung zu bringen, und tatsächlich haben Interventionsstudien mit bestimmten Bakterienstämmen wie Akkermansia muciniphila Auswirkungen auf fettleibigkeitsbezogene Parameter gezeigt. T2D ist auch durch ein beeinträchtigtes Darmmikrobiom in asiatischen und europäischen Populationen gekennzeichnet. Bei T2D wurden mikrobielle Variationen stark mit dem Vorhandensein einer Insulinresistenz korreliert, und mehrere Studien deuten darauf hin, dass das Darmmikrobiom die Glukoseregulation beeinflusst. Die NAFLD ist derzeit die häufigste chronische Lebererkrankung in der westlichen Welt und gilt als prototypische Stoffwechselstörung an der Schnittstelle von Fettleibigkeit, metabolischem Syndrom und T2D. Es gibt immer mehr Hinweise darauf, dass die Achse Darmmikrobiom-Leber bei NAFLD eine Rolle spielt, insbesondere bei Fibrose und fortgeschrittenen Krankheitsstadien wie der nichtalkoholischen Lebersteatose. Mehrere Studien haben nun gezeigt, dass NAFLD durch eine Blüte bestimmter Enterobacteriaceae, E. coli und eine Abnahme von F. prausnitzii gekennzeichnet ist. Jüngste Daten deuten auch darauf hin, dass bei NAFLD Abweichungen und Instabilität des Mikrobioms über viele Jahre hinweg bestehen und sogar der Entwicklung von NAFLD und T2D vorausgehen können. Es gibt eine wachsende Zahl von GI- und Stoffwechselerkrankungen, bei denen das Darmmikrobiom untersucht wurde (siehe Tabelle 1 für einen Überblick).
Abbildung 1
Gesamthäufigkeit der Bakterien nach den verschiedenen Körperstellen. Grenzwerte für die Bakterienzahl in verschiedenen Organen, abgeleitet aus Bakterienkonzentrationen und Volumen.
Darmmikroben und Stoffwechselstörungen: molekulare Akteure
Die bakterielle Gemeinschaft des Darms spielt eine wichtige Rolle bei der Regulierung verschiedener Aspekte von Stoffwechselstörungen. Diese Regulierung hängt unter anderem von der Produktion einer Vielzahl von Metaboliten durch die Mikrobiota und von ihren Wechselwirkungen mit Rezeptoren auf den Wirtszellen ab, die Signalwege aktivieren oder hemmen und für die Gesundheit des Wirts sowohl nützlich als auch schädlich sein können (Abbildung 2).
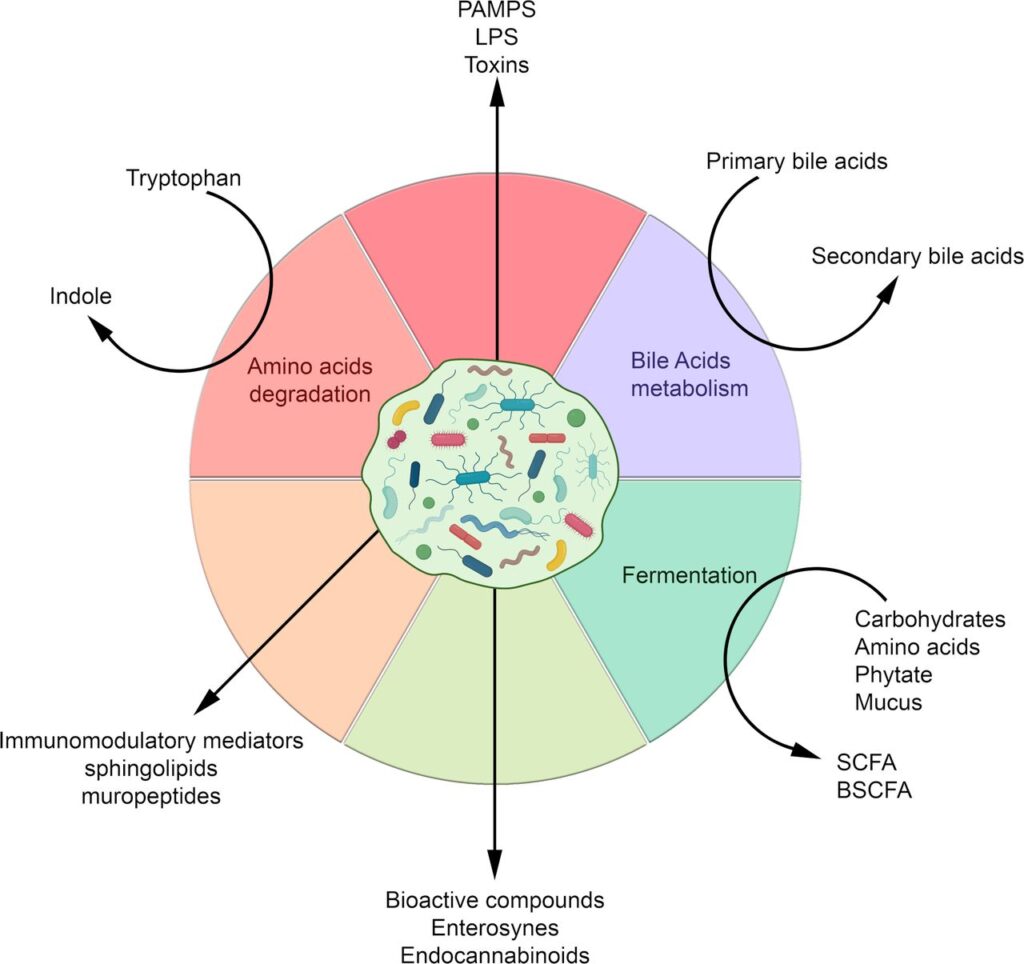
Abbildung 2
Moleküle und Metaboliten, die von der Darmmikrobiota je nach Nährstoff- oder Stoffwechselquelle produziert werden, und ihre abgeleiteten Verbindungen. BSCFA, verzweigte SCFA; LPS, Lipopolysaccharide; PAMPs, Pathogen-assoziierte molekulare Muster; SCFA, kurzkettige Fettsäuren.
Die bakteriellen Stoffwechselprodukte, die an diesen Interaktionen beteiligt sind, sind sehr vielfältig und reichen von kleinen Molekülen bis zu großen Makromolekülen. Sie umfassen Nebenprodukte des bakteriellen Stoffwechsels, wie SCFAs, und komplexe Makromoleküle, die für die bakterielle Integrität notwendig sind, wie Peptidoglykan und Lipopolysaccharide (LPS) (Abbildung 2).
Die Häufigkeit und Verfügbarkeit dieser Metaboliten hängt von der mikrobiellen Zusammensetzung ab und wird daher durch die Ernährung und Umweltfaktoren beeinflusst. Die wichtigsten molekularen Akteure werden im Folgenden erläutert.
Kurzkettige Fettsäuren und ihre Auswirkungen auf die Gesundheit des Wirts: molekulare Mechanismen
Der Dünndarm ist hochspezialisiert auf den Abbau, die Emulgierung und die Aufnahme von Nährstoffen, und nur wenige Nährstoffe entgehen der Verdauung. Unter normalen Bedingungen gelangen beispielsweise <5 g/Tag an Fett in den Dickdarm. Das gleiche Prinzip gilt für die Verdauung und Absorption einfacher Kohlenhydrate (die in Zuckermoleküle aufgespalten werden) und der meisten Proteine (die in Aminosäuren umgewandelt werden), auch wenn je nach Verzehrsmenge einige Proteine den Dickdarm erreichen werden. Komplexe Kohlenhydrate, wie z. B. Ballaststoffe, sind dagegen unverdaulich, d. h., dem Körper fehlen die für ihre Verdauung erforderlichen Enzyme, so dass sie im Dünndarm nicht verdaut werden können. Im Dickdarm jedoch können sie von bestimmten dort ansässigen Bakterien als Energiequelle genutzt werden. Verschiedene Darmmikroben tragen zur Metabolisierung dieser unverdaulichen Kohlenhydrate in verschiedene SCFA-Moleküle bei (z. B. Acetat, Butyrat und Propionat). SCFAs sind chemisch gut charakterisiert, und ihre Auswirkungen auf die Gesundheit wurden bereits ausführlich dokumentiert. Diese Verbindungen regulieren zahlreiche Stoffwechselwege im Darm und in der Ferne, z. B. in der Leber, im Fettgewebe, in den Muskeln und im Gehirn (Abbildung 3). Heutzutage ist bekannt, dass diese mikrobiellen Metaboliten zu zahlreichen physiologischen Effekten beitragen, die von der Modulation der Energiehomöostase, des Glukose-/Fettstoffwechsels und der Entzündung bis hin zu Immunität und Krebs reichen.
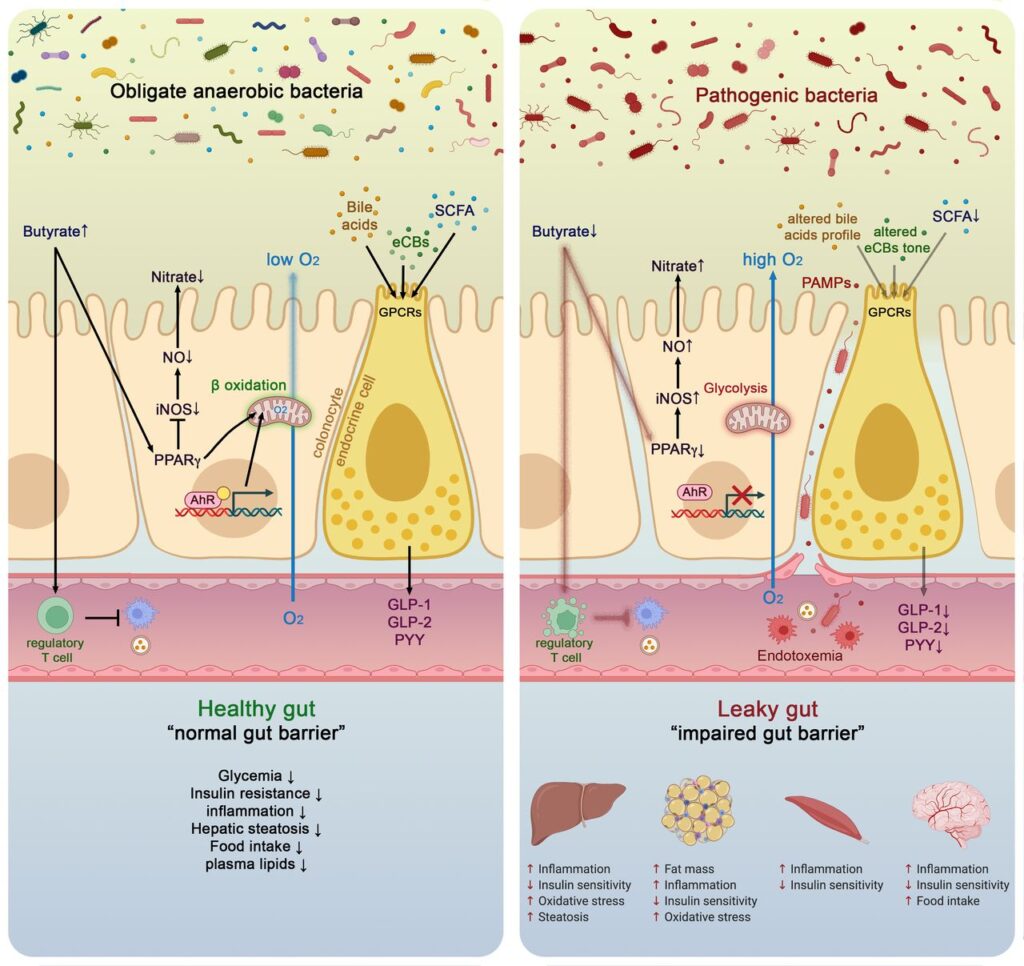
Abbildung 3
Molekulare Mechanismen, die die Darmmikrobiota und die Gesundheit des Wirtes sowohl in gesunden als auch in pathologischen Situationen miteinander verbinden. Im gesunden Zustand verwenden die Kolonozyten Butyrat als Energiesubstrat über die Beta-Oxidation in den Mitochondrien, verbrauchen dabei Sauerstoff und tragen direkt zur Aufrechterhaltung des anaeroben Zustands im Lumen bei. Butyrat bindet auch an den Peroxisom-Proliferator-aktivierten Rezeptor gamma (PPARγ), der wiederum die induzierbare Stickstoffmonoxid-Synthase (iNOS) unterdrückt, die Stickstoffmonoxidproduktion (NO) und schließlich die Nitratproduktion verringert. Umgekehrt ist in pathologischen Situationen ein niedriger Butyratgehalt im Lumen mit einer geringeren PPARγ-Aktivität, einer erhöhten Glykolyse und einem geringeren Sauerstoffverbrauch verbunden. Dies geht mit einer höheren Expression von iNOS einher, die wiederum mehr NO produziert und schließlich die Verfügbarkeit von Nitraten für bestimmte Krankheitserreger erhöht. Butyrat kann auch Immunzellen wie die regulatorischen T-Zellen (Treg) stimulieren, um Entzündungen zu verringern. Der nukleare Transkriptionsfaktor Arylkohlenwasserstoffrezeptor (AhR) wird in gesunden Kolonozyten stark exprimiert und aktiviert, während Agonisten des AhR niedriger sind oder eine reduzierte AhR-Aktivität zu einer veränderten Darmbarrierefunktion führen kann. Enteroendokrine Zellen (L-Zellen) exprimieren mehrere Schlüsselrezeptoren, die durch kurzkettige Fettsäuren (SCFAs), spezifische Endocannabinoide (eCBs) und Gallensäuren (BAs) aktiviert werden. Die Aktivierung dieser Rezeptoren erhöht die Sekretion wichtiger Darmpeptide wie Glucagon-like Peptide (GLP)-1, GLP-2 und Peptid YY (PYY). Insgesamt trägt die Interaktion zwischen den Darmmikroben und diesen molekularen Akteuren dazu bei, die Durchlässigkeit des Darms zu verringern, die Insulinsekretion und die Insulinsensitivität zu verbessern, die Nahrungsaufnahme zu verringern, die Plasmalipide zu senken und Lebersteatose und metabolische Endotoxämie zu vermeiden. Alle diese Wirkungen sind mit einer geringeren Entzündung verbunden. Umgekehrt wurden in pathologischen Situationen gegenteilige Wirkungen beobachtet.
Dank einer Reihe von experimentellen Studien wurden viele der molekularen Mechanismen entdeckt, durch die eine mit fermentierbaren Ballaststoffen (z. B. Präbiotika) angereicherte Ernährung die Gewichtszunahme, die Entwicklung von Fettmasse, die Insulinresistenz und die Energieaufnahme verringern kann. Unter anderem wurde festgestellt, dass die Modulation der Darmmikrobiota durch Präbiotika zu einer höheren endogenen Produktion (d. h. mRNA und Peptide) und Pfortadersekretion mehrerer von den L-Zellen produzierter Darmpeptide wie GLP-1, GLP-2 und Peptid YY (PYY) führt (Abbildung 3).
Diese Wirkungen sind nicht ausschließlich auf eine Art von fermentierbaren Kohlenhydraten beschränkt, da die mikrobielle Fermentation von resistenten Stärken oder Arabinoxylanen zu SCFAs ähnliche physiologische Wirkungen hervorruft, die mit erhöhten GLP-1- und PYY-Plasmaspiegeln verbunden sind. Die chemische Struktur der fermentierbaren Fasern steht jedoch in direktem Zusammenhang mit dem SCFA-Produktionsprofil, da die erzeugte Menge an Butyrat, Acetat oder Propionat von der Art der Fasern abhängt. So wird beispielsweise Inulin als propionogen beschrieben, während resistente Stärken eher butyrogen sind. Bemerkenswert ist, dass einige Kolonbakterien alternative Wege nutzen, um Butyrat aus Aminosäuren wie Lysin oder Propionat aus Pflanzenstoffen wie Phytat zu produzieren. Es ist erwähnenswert, dass die Quellen für SCFAs aus der Nahrung stammen und dass sie vom Wirt selbst durch die Fermentation des Darmschleims, der die Darmepithelzellen bedeckt, stammen können.
SCFAs stimulieren die Sekretion von Darmpeptiden, indem sie auf spezifische G-Protein-gekoppelte Rezeptoren wirken, die an der Oberfläche der enteroendokrinen L-Zellen exprimiert werden, die insbesondere im terminalen Ileum und im Dickdarm reichlich vorhanden sind. Diese Rezeptoren mit der Bezeichnung G-Protein-gekoppelter Rezeptor (GPR)43 (oder Rezeptor für freie Fettsäuren 2 (FFAR2)) und GPR41 (oder FFAR3) (Abbildung 4),73 werden auch in einer Vielzahl von Geweben und Zelltypen (z. B. Adipozyten, Immunzellen) exprimiert. Die Schlüsselrolle, die das Mikrobiom bei der Sekretion von Darmpeptiden spielt, wurde anhand von Mausmodellen aufgeklärt, denen entweder GPR43 oder GPR41 fehlt. Mäuse, denen diese Rezeptoren fehlen, weisen eine verminderte Sekretion von GLP-1 und PYY auf, nachdem sie SCFAs oder spezifischen Präbiotika ausgesetzt waren (Abbildung 3).
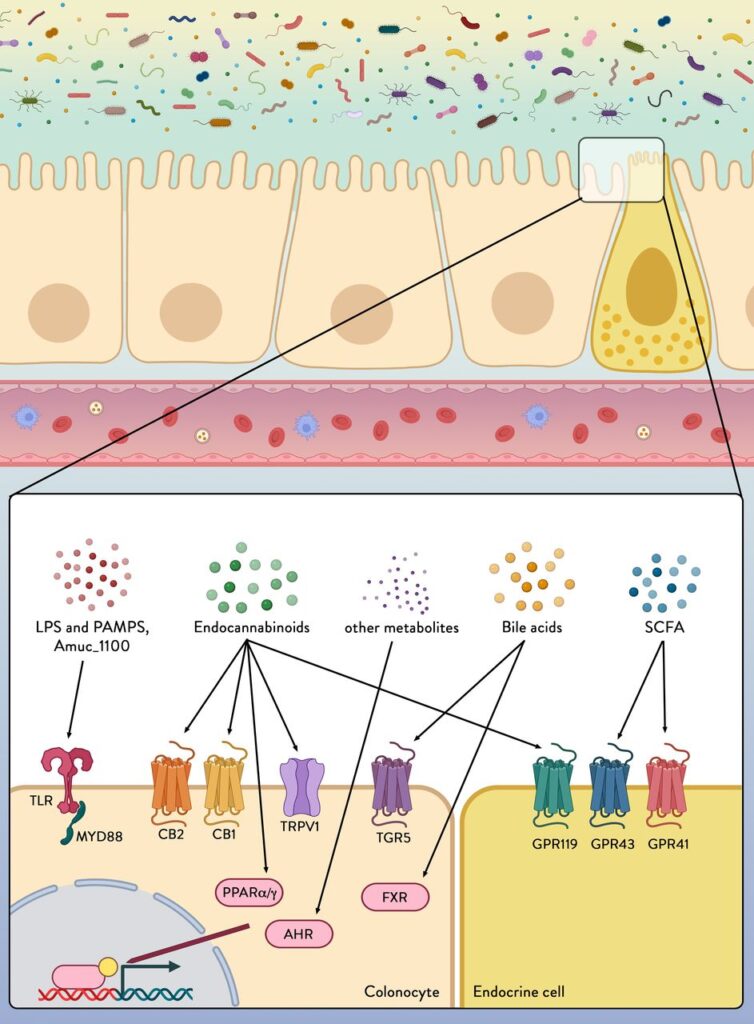
Abbildung 4
Kolonozyten und endokrine Zellen besitzen eine Vielzahl von Rezeptoren, die Signale aus der mikrobiellen Umgebung wahrnehmen und weiterleiten können. Mikroben-/Pathogen-assoziierte molekulare Muster (PAMPs), Lipopolyscaccharide (LPS) aus der Mikrobiota werden von Mustererkennungsrezeptoren, einschließlich Toll-like-Rezeptoren (TLRs), erkannt. Amuc_1100 ist ein Protein, das auf der Außenmembran von Akkermansia muciniphila exprimiert wird und das nachweislich über TLR2 die Barrierefunktion des Darms verbessert und Entzündungen reduziert. Metaboliten, die von bestimmten Mikroben sezerniert werden (z. B. Endocannabinoide (eCBs)), die durch mikrobielle Verdauung von Nahrungsbestandteilen (z. B. kurzkettige Fettsäuren (SCFAs)) oder durch die Umwandlung von Wirtsfaktoren (z. B. eCBs und Gallensäuren) entstehen, können über verschiedene Rezeptoren und Wege wahrgenommen werden, um die Integrität des Darms und die Gesundheit des Wirts zu verändern. CB1, CB2, Cannabinoidrezeptor Typ 1 und Typ 2; TRPV1, transient receptor potential cation channel subfamily V member 1; FXR, Farnesoid X receptor; AhR, aryl hydrocarbon receptor; GPR119, GPR43, GPR41, G-Protein-gekoppelter Rezeptor 119, 43 und 41; MYD88, myeloische Differenzierungsreaktion 88; PPARα/γ, Peroxisom-Proliferator-aktivierte Rezeptoren alpha und gamma; TGR5, Takeda G-Protein-gekoppelter Rezeptor 5.
Zusätzlich zu ihrer bekannten Rolle und ihren Wirkmechanismen könnten einige SCFAs auch andere Funktionen ausüben, als bisher angenommen wurde. So wurde Butyrat bereits mehrfach als wesentliche Energiequelle für die Dickdarmzellen beschrieben, die sich vermehren und die Darmbarriere aufrechterhalten. Neuere Erkenntnisse zeigen jedoch, dass Butyrat auch das mikrobielle Milieu stark beeinflusst, indem es mit den Dickdarmzellen kommuniziert. In der Tat ist der Überfluss an Sauerstoff im luminalen Teil des Darms und seine allmählich abnehmende Konzentration in Richtung Epithel eine wichtige Voraussetzung dafür, dass anaerobe Bakterien in der Nähe des Epithels verbleiben, im Gegensatz zu fakultativen Anaerobiern wie Enterobacteriaceae (Stamm Proteobacteria), die nachweislich das Risiko einer Darmentzündung erhöhen (Abbildung 3). Butyrat trägt zur Kontrolle der anaeroben Bedingungen im Dickdarm bei, indem es die β-Oxidation in den Mitochondrien aktiviert. Durch die Aktivierung des Kernrezeptors Peroxisom-Proliferator-aktivierter Rezeptor gamma (PPARγ) in den Dickdarmzellen begrenzt Butyrat die Diffusion von Sauerstoff aus den Dickdarmzellen in den luminalen Teil und erhält so die anaeroben Bedingungen aufrecht. Die Aktivierung von PPARγ unterdrückt auch die Expression des Gens, das für die induzierbare Stickstoffmonoxid-Synthase kodiert, wodurch die NO-Produktion und letztlich die luminalen Nitratwerte reduziert werden, die als spezifische Energiequellen für die Vermehrung von mutmaßlich pathogenen fakultativen Anaerobiern (Enterobacteriaceae) dienen (Abbildung 3).
Ähnliche Beobachtungen wurden bei Menschen mit schweren Darmentzündungen gemacht, wie z. B. bei CED, Krebs, Fettleibigkeit und Diabetes, bei denen eine erhöhte Abundanz von Enterobacteriaceae festgestellt wurde.
Auffallend ist, dass zahlreiche Arbeiten darauf hinweisen, dass all diese Krankheiten auch mit einer verminderten Abundanz von Bakterien einhergehen, die SCFAs, vor allem Propionat und Butyrat, produzieren. Dies gilt beispielsweise für die Bakterien F. prausnitzii, A. muciniphila und neuerdings Dysosmobacter welbionis. Ein besonderer Fall sind Anaerostipes und Anaerobutyricum spp, die in Gegenwart von Acetat über den Acetyl-CoA-Weg Butyrat aus Laktat erzeugen. Diese können trophische Ketten im Dünn- und Dickdarm bilden, wo eine Vielzahl von Bakterien Laktat produziert. Die Anhäufung von Laktat, einer unerwünschten Säure, im Darmmilieu führt zu Störungen des Magen-Darm-Trakts, was möglicherweise einige Vorteile von Interventionen mit butyrogenem A. soehngenii bei Personen mit metabolischem Syndrom erklärt.
Neben Propionat und Butyrat werden auch die Auswirkungen von Succinat (Unter dem Begriff Succinate werden die Salze der Bernsteinsäure (HOOC–CH2CH2–COOH) verstanden.) untersucht. Succinat ist am besten als Zwischenprodukt des Citratzyklus bekannt und gilt als Substrat für die oxidative Phosphorylierung in den Mitochondrien, ist aber auch ein Stoffwechselprodukt von Bakterien. In diesem Zusammenhang wurde Succinat klassischerweise ignoriert, da es hauptsächlich als Schlüsselzwischenprodukt bei der Propionatsynthese angesehen wurde. Gegenwärtig ist die Rolle von Succinat noch weitgehend umstritten , da sowohl positive als auch gegenteilige Assoziationen zwischen Succinat und Insulinresistenz, Fettleibigkeit und Entzündungen berichtet wurden.
Lipopolysaccharide/Pathogen-assoziierte molekulare Muster
Die Darmbarriere ist eine komplexe und dynamische Ansammlung von physikalischen und chemischen Strukturen, die die Umwelt überwachen und den Wirt vor mikrobiellen Eindringlingen und schädlichen Reizen schützen. Einige dieser gefährlichen Komponenten aus der Umwelt sind die so genannten pathogen-assoziierten molekularen Muster (PAMPs), von denen bakterielle LPS die prototypische Klasse darstellen.
LPS, Endotoxine, die sich auf den Zellmembranen gramnegativer Bakterien befinden, sind starke Aktivatoren der Entzündungsreaktion, und die Freisetzung selbst kleiner Mengen von LPS in den Blutkreislauf reicht aus, um eine Entzündungsreaktion auszulösen.
LPS und andere PAMPs entfalten ihre Wirkung durch die Aktivierung spezifischer Mustererkennungsrezeptoren (PRRs), die Mikroorganismen und Infektionserreger erkennen und eine Abwehrreaktion signalisieren. Es gibt vier große Unterfamilien von PRRs: die Toll-like-Rezeptoren (TLRs), die Nukleotid-bindenden Oligomerisierungsdomänen-Leucin-reiche Wiederholungen (LRR)-enthaltenden Rezeptoren, die Retinsäure-induzierbaren Gen 1 (RIG-1)-ähnlichen Rezeptoren (auch bekannt als RIG-1-ähnliche Helikasen) und die C-Typ Lektin-Rezeptoren. Unter diesen sind die TLRs, eine Rezeptorfamilie mit 10 Mitgliedern beim Menschen (13 bei Mäusen), am besten charakterisiert. Jeder der TLRs vermittelt Reaktionen auf verschiedene mikrobielle Komponenten, die von Krankheitserregern stammen. Zwei typische Beispiele sind TLR2, der bakterielle Lipoproteine wahrnimmt, und TLR4, der bakterielles LPS erkennt. Zusammen decken die TLRs ein breites Spektrum an externen Reizen (PAMPs) und internen Signalen ab, die von Gewebeschäden herrühren (damage-associated molecular patterns (DAMPs)) (Abbildungen 3 und 4). Diese Liganden gibt es in vielen Formen und Größen: von Nukleinsäuren bis zu Lipiden, von kleinen Verbindungen bis zu Makromolekülen. TLRs sind in Immunzellen wie Makrophagen, Neutrophilen, dendritischen Zellen, natürlichen Killerzellen, Mastzellen, Basophilen und Eosinophilen , aber auch in anderen Körperzellen wie Darmepithelzellen weit verbreitet. Ihre Aktivierung führt zu einer Aktivierung der Antigen-präsentierenden Zellen, wodurch eine Brücke zwischen der angeborenen und der adaptiven Immunantwort geschlagen wird, und stimuliert Signalkaskaden, um mikrobielle Eindringlinge abzuwehren oder das beschädigte Gewebe zu reparieren. Obwohl diese Entzündungsreaktion zur Beseitigung der Infektion erforderlich ist, kann eine übermäßige Aktivierung der TLRs zu einer Störung der Immunhomöostase führen, und die anhaltende Produktion von proinflammatorischen Zytokinen und Chemokinen kann das Risiko von Entzündungskrankheiten und Autoimmunstörungen erhöhen. Dies ist bei der metabolischen Endotoxämie der Fall, bei der fettreiche Ernährung und Gewichtszunahme mit einer höheren Darmpermeabilität und einem anschließenden systemischen (leichten) Anstieg des zirkulierenden Plasma-LPS in Verbindung gebracht werden. Dies führt zu einem Zustand niedriggradiger Entzündung, der ein pathologisches Merkmal einer Reihe chronischer Erkrankungen wie T2D, NAFLD, chronische Nierenerkrankung und Atherosklerose ist. Interessanterweise haben LPS von verschiedenen Bakterientypen unterschiedliche Auswirkungen auf die Funktion der Darmschranke, die Fettentzündung, die intestinale Glukoseabsorption, den Blutzuckerspiegel, Insulin und Inkretine, was darauf hindeutet, dass der Nettoeffekt der metabolischen Endotoxämie auf den Wirtsstoffwechsel in Abhängigkeit von der Zusammensetzung der Darmmikrobiota variieren kann.
Eine Störung der Expression von PRRs wurde mit Veränderungen in der Zusammensetzung der Mikrobiota in Verbindung gebracht, die Entzündungen begünstigen. So entwickeln beispielsweise Mäuse mit einem Mangel an TLR5, der durch bakterielles Flagellin aktiviert wird, eine Kolitis oder ein metabolisches Syndrom, das mit einer veränderten Mikrobiota in Zusammenhang steht.
Es hat sich gezeigt, dass die TLR-Aktivierung nachgeschalteter Signalwege vom Protein Myeloid Differentiation Factor 88 (MyD88) abhängig ist (Abbildung 4). MyD88 ist ein essenzielles Adaptorprotein für alle TLRs, mit Ausnahme von TLR3106 , und die Deletion von MyD88 im Darm schützt teilweise vor ernährungsbedingter Fettleibigkeit, Diabetes und Entzündungen und erhöht entzündungshemmende Endocannabinoide (eCBs), stellt die Produktion antimikrobieller Peptide wieder her und erhöht die Zahl der regulatorischen T-Zellen im Darm während der ernährungsbedingten Fettleibigkeit.
Obwohl noch viele Fragen zu beantworten sind, bevor wir vollständig verstehen, wie PAMS/DAMPS, PRRs, das Mikrobiom und der Krankheitszustand zusammenwirken, eröffnet unser wachsendes Verständnis dieses komplexen Zusammenspiels neue therapeutische Möglichkeiten für entzündungsabhängige Erkrankungen.
Bioaktive Lipide
Endocannabinoid-System
In den letzten zwei Jahrzehnten wurde das eCB-System aufgrund seiner vielfältigen physiologischen Wirkungen umfassend erforscht. Neben seinen pleiotropen Wirkungen scheint das eCB-Signalsystem eine Schlüsselrolle bei der Regulierung des Energie-, Glukose- und Fettstoffwechsels zu spielen, aber auch bei der Immunität, bei Entzündungen und in jüngster Zeit bei Mikrobiota-Wirt-Interaktionen.
Historisch gesehen wurde 1988 der erste endogene Cannabinoidrezeptor vom Typ 1 (CB1) identifiziert, der durch die psychoaktive Substanz von Cannabis sativa, Δ9-Tetrahydrocannabinol, aktiviert wird, gefolgt von der Entdeckung eines zweiten Rezeptors im Jahr 1993, dem Cannabinoidrezeptor vom Typ 2 (CB2). Beide Rezeptoren sind GPRs und haben gemeinsame Signalmechanismen. Der erste identifizierte endogene Agonist war Anandamid (N-Arachidonoylethanolamid (AEA)). AEA ist eines der wichtigsten Mitglieder einer großen Gruppe bioaktiver Lipide, die zur Familie der N-Acylethanolamine (NAE) gehören. Der zweite identifizierte Schlüsselligand war 2-Arachidonoylglycerol (2-AG). Seit der Entdeckung dieser beiden wichtigen Verbindungen wurde die eCB-Familie erweitert und ist nicht mehr nur auf eCBs mit spezifischer Aktivität an CB1- und CB2-Rezeptoren beschränkt. So interagieren einige eCBs auch mit PPARα und PPARγ sowie mit anderen Membranrezeptoren wie GPR55 oder Transient-Receptor-Potential-Vanilloid Typ-1 (TRPV1) (Abbildung 4). Neben den so genannten „echten“ eCBs, d. h. eCBs, die CB1 und CB2 binden können, haben zahlreiche andere Verbindungen mit struktureller Ähnlichkeit zu den prototypischen eCBs gezeigt, dass sie die eCB-Reaktion beeinträchtigen, ohne die CB1- oder CB2-eCB-Rezeptoren direkt zu aktivieren. Alle diese Moleküle werden als eCB-ähnliche Verbindungen oder Kongenere bezeichnet und sind bioaktive Lipide, einschließlich anderer NAEs oder Mitglieder der Acylglycerinfamilie. eCB-ähnliche Verbindungen können jedoch auch eine eigene pharmakologische Wirkung entfalten. So können beispielsweise N-Oleoylethanolamin (OEA) oder N-Palmitoylethanolamin (PEA) PPARα und TRPV1 aktivieren, und OEA, N-Linoleylethanolamin (LEA) und 2-Oleoylglycerin (2-OG) sind in der Lage, GPR119 zu aktivieren. 117 Kürzlich wurde gezeigt, dass sowohl 1-Palmitoylglycerin (1-PG) als auch 2-Palmitoylglycerin (2-PG) PPARα-Agonisten sind (Abbildung 4).
Im Jahr 2010 wurde entdeckt, dass unter den Stoffwechselsystemen, die an der Regulierung der Darmbarrierefunktion beteiligt sind, das eCB-System eine wichtige Rolle spielt. Es begann mit der Feststellung, dass das intestinale eCB-System bei Adipositas und Diabetes verändert ist, mit einer erhöhten Abundanz von AEA, das die Darmpermeabilität über CB1-abhängige Mechanismen auslöst. Interessanterweise war diese Modifikation des eCB-Systemtons mit Veränderungen der Darmmikrobiota verbunden. Darüber hinaus führte die pharmakologische Aktivierung des eCB-Systems mit einem potenten eCB-Agonisten zu einer erhöhten Adipogenese und einer Störung der Darmbarriere. In einer Reihe unabhängiger Studien wurde der Zusammenhang zwischen der Darmmikrobiota, dem Stoffwechsel des Fettgewebes und dem eCB-System bestätigt, da sowohl genetisch fettleibige als auch diabetische Mäuse (ob/ob und db/db) eine tiefgreifende Verschiebung in der Zusammensetzung ihrer Darmmikrobiota aufweisen, die mit einem veränderten Stoffwechsel des gesamten Körpers und dem Tonus des eCB-Systems einhergeht. Zusammengenommen sprechen diese Daten stark für einen Zusammenhang zwischen spezifischen bioaktiven Lipiden, die zum eCB-System gehören, und der Darmmikrobiota, der Entwicklung des Fettgewebes und der Darmfunktion.
Um die zugrundeliegenden Mechanismen weiter zu erforschen und zu zeigen, ob die Synthese dieser NAEs am Auftreten von Stoffwechselstörungen und Veränderungen in der Darmmikrobiota beteiligt sein könnte, wurden mehrere Mausmodelle erzeugt, bei denen die N-Acylphosphatidylethanolamin-hydrolyse-spezifische Phospholipase D (NAPE-PLD), ein Schlüsselenzym der Synthese, entweder in Adipozyten, Darmepithelzellen oder Hepatozyten inaktiviert wurde.
Mäuse, denen NAPE-PLD in Adipozyten fehlte, entwickelten spontan Fettleibigkeit, Insulinresistenz und Entzündungen bei normaler Kaloriendiät und waren empfindlicher gegenüber Stoffwechselstörungen, die durch fettreiche Diäten ausgelöst wurden. Die adipozytenspezifische Deletion von NAPE-PLD verringerte das thermogene Programm (d. h. Bräunung/Bräunung) im Fettgewebe und führte zu einer tiefgreifenden Veränderung der Zusammensetzung der Darmmikrobiota. Darüber hinaus replizierte die Übertragung der Mikrobiota von Mäusen, bei denen NAPE-PLD aus dem Fettgewebe entfernt wurde, auf keimfreie Empfängermäuse den Gesamtphänotyp, was auf eine kausale Rolle der Darmmikrobiota hindeutet. Bei der Deletion von NAPE-PLD in Darmepithelzellen trat ein anderer Phänotyp auf. Die Mäuse wurden hyperphag, als sie zum ersten Mal einer fettreichen Diät ausgesetzt wurden, und entwickelten dann eine verstärkte diätbedingte Fettleibigkeit und Lebersteatose. Mechanistisch gesehen wurde dies auf einen Defekt in der Darm-Gehirn-Achse zurückgeführt, da Veränderungen in den hypothalamischen Pomc-Neuronen festgestellt wurden, die sich wahrscheinlich durch Veränderungen der eCBs im Darm und im Plasma erklären lassen. Bemerkenswerterweise war in diesem Modell auch die Darmmikrobiota betroffen, und eine Modulation der Mikrobiota konnte den Phänotyp teilweise umkehren. Im letzten Modell entwickelten Mäuse, bei denen die NAPE-PLD in den Hepatozyten deletiert wurde, unter normaler Ernährung einen fettreichen Diät-ähnlichen Phänotyp (d. h. erhöhte Zunahme der Fettmasse, Lebersteatose, Leberentzündung). Diese Effekte standen in Zusammenhang mit Veränderungen anderer wichtiger bioaktiver Lipide, von denen bekannt ist, dass sie von der Darmmikrobiota beeinflusst werden, wie z. B. BAs.124 Insgesamt deuten all diese Daten und Tiermodelle darauf hin, dass das eCB-System über die NAPE-PLD mit der Darmmikrobiota über die Produktion bioaktiver Lipide in Dialog steht, und dass eine Dysregulation dieses Enzyms wiederum zu metabolischen Komplikationen führen kann.
Um die möglichen Verbindungen zwischen der Darmmikrobiota und der Regulierung des eCB-Systems weiter zu erforschen, wurde das Endocannabinoidom (eCBome) von keimfreien Mäusen mit dem von konventionellen Mäusen zu verschiedenen Zeitpunkten verglichen. Das eCBome ist eine Erweiterung des eCB-Systems, das mehr als 50 Rezeptoren und Stoffwechselenzyme sowie >20 Lipidmediatoren mit wichtigen Funktionen umfasst. Es wurde eine altersabhängige Veränderung der intestinalen eCBome-Genexpression und der Lipidmediatorenspiegel festgestellt. Auffallend ist, dass die Transplantation von Fäkalienmaterial von Kontrollmäusen auf altersgleiche keimfreie Mäuse mehrere dieser Veränderungen bereits nach nur einer Woche rückgängig machte. Insgesamt zeigen diese Studien, dass die Darmmikrobiota einen direkten Einfluss auf das eCBome des Wirts hat.
Alles deutet also auf eine bidirektionale Wechselwirkung zwischen dem eCB-System des Wirts und der Darmmikrobiota hin. Es sind jedoch weitere Untersuchungen erforderlich, um die vielen verbleibenden Rätsel dieser Beziehung zu entschlüsseln. Kürzlich wurde gezeigt, dass die Darmmikrobiota selbst in der Lage ist, spezifische eCBs zu produzieren. Dies eröffnet neue spannende Möglichkeiten zur Erforschung der Interaktion zwischen Mikrobiota und Wirt und bietet mehrere neue mögliche Angriffspunkte für die Therapie.
Gallensäuren
Primäre Gallensäuren wie Cholsäure (CA) und Chenodeoxycholsäure (CDCA) beim Menschen (und Muricholsäure (MCA) bei Nagetieren) sind amphipathische Moleküle, die in der Leber aus Cholesterin synthetisiert werden. Sie können mit Glycin oder Taurin konjugiert werden, bevor sie in die Galle ausgeschieden und in der Gallenblase gespeichert werden. Bei der Nahrungsaufnahme werden BAs (Gallensäuren) in den Dünndarm freigesetzt, wo sie bei der Verdauung und Absorption von Nahrungsfett helfen. Etwa 95 % der BAs aus dem Darm werden im Ileum resorbiert und kehren zur erneuten Sekretion in die Leber zurück (Gallensäurenrückgewinnung). Dieser enterohepatische Kreislauf von BAs findet mehrmals täglich statt und ist ein wichtiger physiologischer Mechanismus zur Aufrechterhaltung der Glukose-, Lipid- und Energiehomöostase des gesamten Körpers, um Hyperglykämie, Dyslipidämie und Fettleibigkeit zu verhindern, und er schützt vor entzündlichen Stoffwechselerkrankungen des Verdauungs- und Herz-Kreislauf-Systems. Nur ein kleiner Teil der BAs entkommt diesem hocheffizienten Kreislauf und erreicht den Dickdarm. Diese BAs werden dann entweder passiv in den Kreislauf rückresorbiert oder über die Fäzes ausgeschieden. Die BA-Verluste werden durch eine hepatische De-novo-Synthese kompensiert, die beim Menschen durch den Fibroblasten-Wachstumsfaktor 19 (FGF19) reguliert wird, der im Dünndarm signalisiert wird (FGF15 bei Nagern).
Obwohl die primäre Funktion der BAs darin besteht, die Verdauung und Absorption von Cholesterin, Triglyceriden und fettlöslichen Vitaminen zu regulieren, hat man vor kurzem erkannt, dass BAs auch eine endokrine Funktion haben, da sie als Signalmoleküle wirken. Darüber hinaus wurde nachgewiesen, dass BAs die Proliferation von Epithelzellen, die Genexpression, den Lipid-, Glukose- und Energiestoffwechsel durch die Aktivierung verschiedener Rezeptoren modulieren. Bei diesen Rezeptoren handelt es sich um den Vitamin-D-Rezeptor, den Pregnan-X-Rezeptor, den konstitutiven Androstan-Rezeptor, den Farnesoid-X-Rezeptor und den G-Protein-gekoppelten Gallensäure-Rezeptor-1 (auch bekannt als Takeda G-Protein-gekoppelter Rezeptor 5 (TGR5)) (Abbildung 4). Diese Rezeptoren kommen in zahlreichen Geweben vor, u. a. in der Leber, im Darm, im Muskel, im braunen Fettgewebe sowie im zentralen und peripheren Nervensystem, und vermitteln die Signalkaskade und aktivieren die Expression von Genen, die am Stoffwechsel von BA, Lipiden und Kohlenhydraten sowie am Energieverbrauch und an Entzündungen beteiligt sind. Die Signalübertragung durch FXR- und TGR5-Rezeptoren wurde auch mit der Sekretion von GI-Hormonen wie PYY und GLP-1 in Verbindung gebracht (Abbildungen 3 und 4), die bekanntermaßen für die Aufrechterhaltung der Energie- und Stoffwechselhomöostase wichtig sind. Die Rolle der BAs bei der Kontrolle des Glukose-, Lipid- und Energiestoffwechsels wurde bereits in früheren Berichten behandelt und wird daher hier nicht im Einzelnen dargestellt.
Primäre BAs können durch Darmmikroben im gesamten Darmtrakt verändert werden. Zu diesen Modifikationen gehören die Dekonjugation (die Entfernung von Aminosäureresten) durch die Aktivität der Gallensalzhydrolase (BSH) und die weitere Metabolisierung durch Entfernung von Hydroxylgruppen (Dehydroxylierung), Oxidation (Dehydrierung) oder Epimerisierung. Dies führt zur Bildung sekundärer BAs wie Desoxycholsäure, Lithocholsäure und Ursodeoxycholsäure (eine sekundäre BA beim Menschen, obwohl sie bei Nagetieren eine primäre BA ist). Dieser bakterielle Stoffwechsel verändert die Bioverfügbarkeit und die Bioaktivität der BAs und folglich auch ihre Auswirkungen auf die Stoffwechselreaktionen, an denen sie beteiligt sind. Aufgrund ihrer Signalkapazitäten und der Tatsache, dass BAs von der Darmmikrobiota chemisch umgewandelt werden, können BAs daher als von der Mikrobiota stammende Signalmetaboliten betrachtet werden. Interessanterweise ist ein räumlich-zeitliches Muster zu erkennen, da BAs nach der Nahrungsaufnahme freigesetzt werden und dann entlang des Darmtrakts auf verschiedene mikrobielle Gemeinschaften treffen. Während die BSH-Aktivität von einer Vielzahl von Bakterien durchgeführt werden kann, die sich auf viele phylogenetisch unterschiedliche bakterielle Abteilungen verteilen, darunter auch Arten, die den Dünndarm besiedeln können, sind die anderen Reaktionen vermutlich auf spezialisiertere Bakterienarten beschränkt, die sich im distalen Teil des Darms aufhalten. Um die Rolle der Darmmikrobiota auf den Stoffwechsel des Wirts vollständig zu verstehen, ist es daher unerlässlich, die Beteiligung der verschiedenen Bakterien, die BAs umwandeln können, zu untersuchen. Eine kürzlich durchgeführte Studie an Hundertjährigen deutet darauf hin, dass ihre spezifische Darmmikrobiota teilweise für ihre geringere Anfälligkeit für altersbedingte Krankheiten, chronische Entzündungen und Infektionskrankheiten verantwortlich sein könnte, indem sie einzigartige sekundäre BAs erzeugt. Dies bedeutet, dass die Beeinflussung des BA-Pools durch Modulation der Zusammensetzung der Darmmikrobiota ein gangbarer Weg zur Bekämpfung von Krankheiten sein könnte.
Aryl-Kohlenwasserstoff-Rezeptor: eine Verbindung zu Energiestoffwechsel, Entzündung und Darmmikrobiom
Der Arylkohlenwasserstoffrezeptor (AhR) wird ubiquitär (überall) in Wirbeltierzellen exprimiert, und dieser Transkriptionsfaktor wird nach Bindung eines Liganden aktiviert. Es gibt zahlreiche AhR-Liganden, darunter Auslöser aus der Umwelt, Signale aus der Ernährung, verschiedene Phytochemikalien und bakterielle Metaboliten wie Tryptophan (Abbildung 2). Die Bindung des AhR-Liganden führt zur Verlagerung des AhR in den Zellkern, wo er an sein Dimerisierungsmolekül AhR nuclear translocator gebunden wird, was zur Transkription zahlreicher Gene führt, die an Immunitäts- und Entzündungsprozessen beteiligt sind (Abbildung 3). Bakterielle Produkte und Metaboliten spielen eine Schlüsselrolle als Aktivatoren, und daher wurde in den letzten Jahren in mehreren Berichten versucht, das Zusammenspiel von AhR mit der Darmmikrobiota zu ergründen (Abbildungen 3 und 4). Wichtig ist, dass dieser AhR-Weg auch mit dem Energiestoffwechsel und dem metabolischen Syndrom in Verbindung gebracht wurde, da beim metabolischen Syndrom sowohl in präklinischen als auch in klinischen Situationen eine verminderte Fähigkeit besteht, Tryptophan in AhR-bindende Derivate zu metabolisieren. Diese Autoren zeigten, dass eine Erhöhung der AhR-Liganden durch die Verabreichung eines Lactobacillus-Stammes die Stoffwechselfunktionen verbessert und gleichzeitig die Darmbarriere verbessert und die hepatische Steatose verringert. Indigo, ein natürlich vorkommender AhR-Ligand mit starker entzündungshemmender Wirkung, schützt vor Fettleibigkeit und Stoffwechselstörungen, die durch eine fettreiche Ernährung hervorgerufen werden, indem er Lactobacillus spp und die wichtigen Barriere-Zytokine Interleukin (IL)-10 und IL-22 hochreguliert. Mikrobielle Tryptophan-Metaboliten wie Indol-3-Ethanol, Indol-3-Pyruvat und Indol-3-Aldehyd schützen die Darmepithelbarriere, indem sie die Integrität des apikalen Junktionskomplexes einschließlich Myosin IIA und Ezrin beeinflussen. Bei experimenteller alkoholischer Lebererkrankung, einer Krankheit, bei der das Darmmikrobiom erheblich beeinträchtigt ist, verbesserten die Induktion von AhR-Liganden und die Verabreichung von 6-Formylindolo(3,2-b)carbazol (Ficz) die alkoholische Lebererkrankung. Caspase-Rekrutierungsdomänen-Familienmitglied 9-/–Mäuse sind anfälliger für Kolitis, und ihre Mikrobiota kann Tryptophan nicht in die entsprechenden Metaboliten umwandeln. Der Transfer dieser Mikrobiota in Wildtyp-Mäuse verstärkt die Kolitis und kann durch die Behandlung mit Lactobacillus-Stämmen, die hohe Mengen an AhR-Liganden liefern, verbessert werden. Der AhR-Signalweg könnte auch bei anderen entzündlichen Erkrankungen des Magen-Darm-Trakts wie der Zöliakie eine wichtige Rolle spielen. Patienten mit aktiver Zöliakie weisen im Vergleich zu Kontrollpersonen ohne Zöliakie eine verringerte Produktion von AhR-Liganden in ihrem Darm auf, und auch bei nicht fettleibigen diabetischen Mäusen, die DQ8 exprimieren (transgene Mäuse, die nur menschliches MHC-Klasse-II-DQ8 tragen), führten eine Diät mit hohem Tryptophananteil, die Behandlung mit Limosilactobacillus reuteri, einem Bakterienstamm, der große Mengen an AhR-Liganden produziert, oder die Behandlung mit dem AhR-Liganden Ficz zu einer Verringerung der Darmpathologien nach Glutenexposition. Keimfreie Mäuse zeigen eine gestörte Differenzierung und Reparatur der epidermalen Barriere, und Mäuse, denen AhR in Keratinozyten fehlt, sind sehr anfällig für Hautinfektionen und Barriereschäden, und die Besiedlung mit einer bestimmten Bakteriengruppe hat die Barriere wiederhergestellt. In diesem Modell muss noch geklärt werden, welche Rolle Darmbakterien in einer vermuteten Darm-Haut-Achse spielen könnten. Der AhR-Signalweg spiegelt daher einen prototypischen Signalweg an der Schnittstelle zwischen Mikrobiota, Epithelbarriere, Stoffwechsel und Immunfunktionen wider.
Aryl-Hydrocarbon-Rezeptor (AhR, Ah-Rezeptor, auch Dioxinrezeptor (veraltet)): eine Verbindung zu Energiestoffwechsel, Entzündung und Darmmikrobiom
Der Aryl-Hydrocarbon-Rezeptor (AhR) wird ubiquitär in Wirbeltierzellen exprimiert, und dieser Transkriptionsfaktor wird nach Bindung eines Liganden aktiviert. Es gibt zahlreiche AhR-Liganden, darunter Auslöser aus der Umwelt, Signale aus der Ernährung, verschiedene Phytochemikalien und bakterielle Metaboliten wie Tryptophan (Abbildung 2). Die Bindung des AhR-Liganden führt zur Verlagerung des AhR in den Zellkern, wo er an sein Dimerisierungsmolekül AhR nuclear translocator gebunden wird, was zur Transkription zahlreicher Gene führt, die an Immunitäts- und Entzündungsprozessen beteiligt sind (Abbildung 3). Bakterielle Produkte und Metaboliten spielen eine Schlüsselrolle als Aktivatoren, und daher wurde in den letzten Jahren in mehreren Berichten versucht, das Zusammenspiel von AhR mit der Darmmikrobiota zu ergründen (Abbildungen 3 und 4). Wichtig ist, dass dieser AhR-Weg auch mit dem Energiestoffwechsel und dem metabolischen Syndrom in Verbindung gebracht wurde, da beim metabolischen Syndrom sowohl in präklinischen als auch in klinischen Situationen eine verminderte Fähigkeit besteht, Tryptophan in AhR-bindende Derivate zu metabolisieren. Diese Autoren zeigten, dass eine Erhöhung der AhR-Liganden durch die Verabreichung eines Lactobacillus-Stammes die Stoffwechselfunktionen verbessert und gleichzeitig die Darmbarriere verbessert und die hepatische Steatose verringert. Indigo, ein natürlich vorkommender AhR-Ligand mit starker entzündungshemmender Wirkung, schützt vor Fettleibigkeit und Stoffwechselstörungen, die durch eine fettreiche Ernährung verursacht werden, indem er Lactobacillus spp. und die wichtigen Barriere-Zytokine Interleukin (IL)-10 und IL-22 hochreguliert. Mikrobielle Tryptophan-Metaboliten wie Indol-3-Ethanol, Indol-3-Pyruvat und Indol-3-Aldehyd schützen die Darmepithelbarriere, indem sie die Integrität des apikalen Junktionskomplexes einschließlich Myosin IIA und Ezrin beeinflussen. Bei experimenteller alkoholischer Lebererkrankung, einer Krankheit, bei der das Darmmikrobiom erheblich beeinträchtigt ist, verbesserten die Induktion von AhR-Liganden und die Verabreichung von 6-Formylindolo(3,2-b)carbazol (Ficz) die alkoholische Lebererkrankung. Caspase-Rekrutierungsdomänen-Familienmitglied 9-/–Mäuse sind anfälliger für Kolitis, und ihre Mikrobiota kann Tryptophan nicht in die entsprechenden Metaboliten umwandeln. Der Transfer dieser Mikrobiota in Wildtyp-Mäuse verstärkt die Kolitis und kann durch die Behandlung mit Lactobacillus-Stämmen, die hohe Mengen an AhR-Liganden liefern, verbessert werden. Der AhR-Signalweg könnte auch bei anderen entzündlichen Erkrankungen des Magen-Darm-Trakts wie der Zöliakie eine wichtige Rolle spielen. Patienten mit aktiver Zöliakie weisen im Vergleich zu Kontrollpersonen ohne Zöliakie eine verringerte Produktion von AhR-Liganden in ihrem Darm auf, und auch bei nicht fettleibigen diabetischen Mäusen, die DQ8 exprimieren (transgene Mäuse, die nur menschliches MHC-Klasse-II-DQ8 tragen), führten eine Diät mit hohem Tryptophananteil, die Behandlung mit Limosilactobacillus reuteri, einem Bakterienstamm, der große Mengen an AhR-Liganden produziert, oder die Behandlung mit dem AhR-Liganden Ficz zu einer Verringerung der Darmpathologien nach Glutenexposition. Keimfreie Mäuse zeigen eine gestörte Differenzierung und Reparatur der epidermalen Barriere, und Mäuse, denen AhR in Keratinozyten fehlt, sind sehr anfällig für Hautinfektionen und Barriereschäden, und die Besiedlung mit einer bestimmten Bakteriengruppe hat die Barriere wiederhergestellt. In diesem Modell muss noch geklärt werden, welche Rolle Darmbakterien in einer vermuteten Darm-Haut-Achse spielen könnten. Der AhR-Signalweg spiegelt daher einen prototypischen Signalweg an der Schnittstelle zwischen Mikrobiota, Epithelbarriere, Stoffwechsel und Immunfunktionen wider.
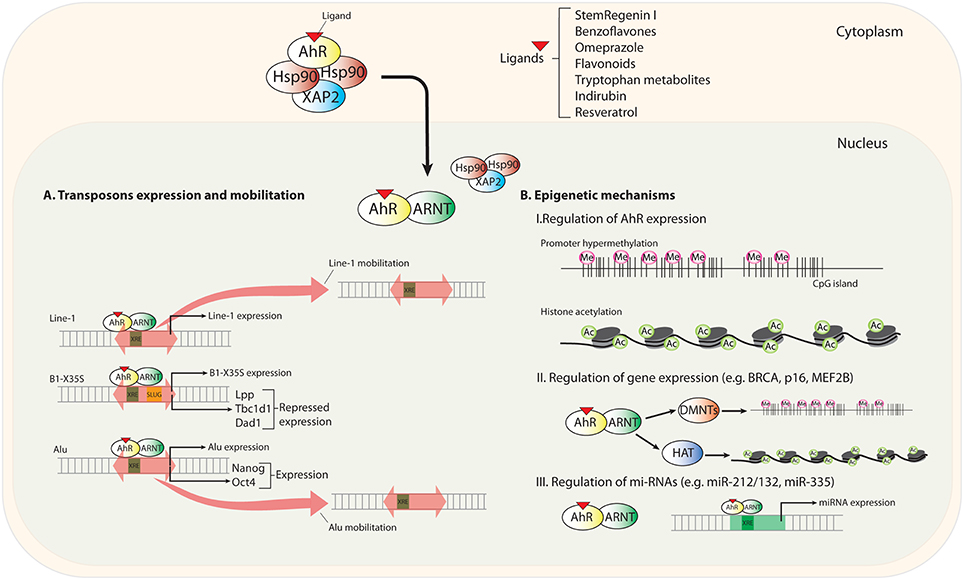
Abbildung 5. Schema, das neue Mechanismen der AhR-Regulierung zusammenfasst. Nach der Bindung eines neuen (nicht-toxischen) Liganden wandert AhR in den Zellkern und heterodimerisiert mit seinem Partnerprotein ARNT. (A) Transponierbare Elemente (TEs) in stromaufwärts gelegenen Promotor- und Enhancer-Sequenzen enthalten Transkriptionsfaktor-Bindungsstellen (TFBSs) für die Genregulation. AhR erkennt Konsensus-XRE-Bindungselemente (xenobiotic responsive element; 5′-GCGTG-3′) in LINE-1-, B1-X35S- und Alu-TEs. Die AhR-vermittelte Regulierung löst die Expression und Mobilisierung dieser TEs aus. (B) Epigenetische Mechanismen zur Regulierung der AhR-Expression und des Status seiner Zielgene und microRNAs. Autorgen: Sonia Mulero-Navarro and Pedro M. Fernandez-Salguero vgl. https://www.frontiersin.org/articles/10.3389/fcell.2016.00045/full
Schlüsselbakterien und ihre spezifischen Moleküle
Die meisten signalgebenden Stoffwechselprodukte können von einer großen Anzahl verschiedener Darmbakterien produziert werden und sind daher nur begrenzt spezifisch. Verschiedene Bakterien können jedoch spezifische Moleküle herstellen, die einzigartige Wechselwirkungen mit dem Wirt haben (Abbildungen 2-4). Aus offensichtlichen Gründen sind diese Moleküle bei Krankheitserregern, die spezifische Toxine herstellen, Polysaccharide synthetisieren, um das Immunsystem zu umgehen, oder den Wirt zur Synthese von Rezeptoren veranlassen, die ihnen das Eindringen ermöglichen, sehr gut charakterisiert. Jüngste Forschungsarbeiten haben jedoch neue und einzigartige Wirtssignalmoleküle identifiziert, die in potenziell symbiotischen Darmbakterien vorkommen. Dazu gehören immunmodulatorische Polysaccharide und Sphingolipide, die von Bacteroides spp. produziert werden, und Muropeptide, die von Enterococcus spp. gebildet werden.
Eine besondere Klasse einzigartiger Moleküle sind Proteine, die genetisch von einem oder wenigen Stämmen derselben Spezies kodiert werden. Einige von ihnen wurden eingehend untersucht und umfassen oft stabile oder posttranslational veränderte Proteine, die das Potenzial haben, mit Wirtsrezeptoren zu interagieren, wenn sie sezerniert werden oder sich in der Zellhülle befinden. Einige davon stammen von Bakterien, die bereits in großem Umfang als Probiotika vermarktet werden, darunter L. acidophilus NCFM, das ein großes, wahrscheinlich glykosyliertes Oberflächenschichtprotein produziert, das dem DC-SIGN-Rezeptor Signale übermittelt, das 90 kDa Pilusprotein SpaC von L. rhamnosus GG, bei dem es sich um ein teilweise glykosyliertes schleimbindendes Protein mit einer ungewöhnlichen Signalkapazität für den DC-SIGN-Rezeptor auf dendritischen Zellen handelt , und das in einigen Bifidobacterium spp. vorkommende Pilusprotein Tad, das die Kolonpersistenz und die Epithelproliferation fördert. Ein kürzlich untersuchtes Protein ist die caseinolytische Protease B (ClpB) von E. coli, die ein Antigen-Mimetikum des Alpha-Melanozyten-stimulierenden Hormons ist und das Sättigungsgefühl über eine erhöhte GLP-1- und PYY-Produktion im Plasma steigert. ClpB-Proteine sind bekannte „Moonlighting“-Proteine, die teilweise von einer Vielzahl von Bakterien, einschließlich Laktobazillen und Bifidobakterien, sezerniert werden. Die Spezifität von ClpB ist jedoch möglicherweise nicht so hoch, da eine ClpB-produzierende Hafnia alvei in einer Humanstudie ebenfalls das Sättigungsgefühl bis zu einem gewissen Grad unterdrückte.
In Anbetracht der Wirksamkeit der Verabreichung von lebendem und pasteurisiertem A. muciniphila in einer Humanstudie ist es nicht überraschend, dass vor kurzem mehrere Proteine aus A. muciniphila mit potenzieller Signalkapazität identifiziert worden sind. Ein kürzlich identifiziertes Protein ist ein 84 kDa großes Protein (kodiert durch das Gen Amuc_1831) mit der Bezeichnung P9, das nach oraler Verabreichung bei Mäusen den Serum-GLP-1-Spiegel ansteigen lässt. In-vitro-Untersuchungen ergaben, dass P9 mit dem Rezeptor für das interzelluläre Adhäsionsmolekül 2 interagiert. Ein weiteres kürzlich entdecktes Protein ist das 50 kDa große Amuc_1434*-Protein von A. muciniphila, das die Lebensfähigkeit von LS174T-Zellen über den durch den Tumor-Nekrose-Faktor induzierten Apoptoseweg (TRAIL) unterdrückt. Beide Proteine kommen jedoch in vielen anderen Bakterien als A. muciniphila vor, beide werden als Proteasen bezeichnet, was auf enzymatische Aktivität schließen lässt, und beide wurden nicht außerhalb der Zellen lokalisiert, was die Möglichkeit nicht ausschließt, dass die Zelllyse für ihre Aktivität erforderlich ist. Noch wichtiger ist, dass ihre Stabilität nicht untersucht wurde, was insofern von Interesse ist, als pasteurisierte A.-muciniphila-Zellen sowohl in Menschen- als auch in Mäusemodellen genauso wirksam oder sogar wirksamer waren als lebende Zellen. All diese Argumente gelten nicht für das andere A. muciniphila-Protein, das als Signalgeber für TLR2 entdeckt wurde (Abbildung 4). Es handelt sich um das 30 kDa große Amuc_1100-Protein, das als Außenmembranprotein definiert wurde, das praktisch keine Homologie zu anderen Bakterien außerhalb der Verrucomicrobia aufweist und von dem man annimmt, dass es ein pilusassoziiertes Protein ist. Weitere Studien zeigten, dass Amuc_1100 thermostabil ist und in einem Mausmodell diätbedingte Fettleibigkeit verhindert. Vergleicht man alle drei Proteine hinsichtlich ihrer absoluten Häufigkeit, so zeigt sich, dass Amuc_1100 in Proteomen von A. muciniphila, die auf Mucin gewachsen sind, viel häufiger vorkommt als die beiden anderen Signalkandidaten. Daher sollten künftige vergleichende Studien ermitteln, welche Proteine oder Kombinationen davon die beobachtete Aktivität von A. muciniphila beim Menschen erklären können.
Neu identifizierte Moleküle, Auswirkungen auf die Gesundheit und ihre Ziele
Neben den klassischen Molekülen wie SCFAs, BAs oder PAMPs und Darmpeptiden (z. B. GLP-1, PYY), die alle als Regulatoren des Wirtsstoffwechsels, der Darmbarriere und der Entzündung beschrieben werden, zeichnet sich die Rolle einer neuen Klasse von Molekülen ab, die als „Enterosyne“ bezeichnet werden. Das Konzept der Enterosyne wurde kürzlich eingeführt und definiert als „Moleküle, die aus dem Darm stammen und die Fähigkeit haben, die Kontraktion des Zwölffingerdarms zu modulieren, indem sie auf das enterische Nervensystem (ENS) einwirken. Enterosyne können chemisch vielfältig sein und mit Hormonen, bioaktiven Peptiden/Lipiden, Nährstoffen, der Mikrobiota und Immunfaktoren zusammenhängen“.
Der Ursprung dieses Konzepts beruht auf der Beobachtung, dass Personen mit T2D durch eine duodenale Hypermotilität gekennzeichnet sind, die die Glukoseabsorption begünstigt und zur Hyperglykämie beiträgt. Es wurde nachgewiesen, dass duodenale Kontraktionen vom Hypothalamus wahrgenommen werden und dass die duodenale Hypermotilität bei Diabetes abweichende afferente Nervenmeldungen an das Gehirn erzeugt. Umgekehrt stellt die Wiederherstellung der natürlichen duodenalen Kontraktion durch Einwirkung auf ENS-Neuronen die Darm-Hirn-Achse wieder her und verbessert die Insulinempfindlichkeit.
Die Zusammenhänge zwischen dem Darmmikrobiom, der Gehirnfunktion und dem Glukosestoffwechsel werden in diesem Forschungsbereich zu einem heißen Thema, und die Rolle des ENS hat sich als neues Ziel zur Bekämpfung von Krankheiten wie Diabetes herausgestellt. Obwohl in verschiedenen Arbeiten Strategien zur Modulation des Darmmikrobioms, wie Probiotika, Präbiotika und Fäkaltransplantationen, im Hinblick auf die Linderung von Merkmalen des metabolischen Syndroms erörtert werden, befassen sich nur wenige, wenn nicht gar keine, mit der Charakterisierung von Darmakteuren wie Enterosynen.
Auf der Suche nach neuen Darmmolekülen und Rezeptoren, die am Glukosestoffwechsel beteiligt sind, wurde die Wirkung spezifischer Fasern untersucht, von denen bekannt ist, dass sie die Darmmikrobiota verändern und den Diabetes verbessern. Die Verabreichung von Oligofruktose verringerte die Kontraktionsfrequenz des Zwölffingerdarms durch die Kontrolle der Aktivität der enterischen Neuronen. Dies führte zu einer geringeren Hyperglykämie und zu einer Verringerung der Entzündungsmarker im Fettgewebe der diabetischen Mäuse. Mit Hilfe der Lipidomanalyse wurde festgestellt, dass diese Oligofruktosefütterung selektiv die Menge eines bioaktiven Lipids (12-Hydroxyeicosatetraensäure (12-HETE)) in den Darmzellen erhöhte. Auffallend ist, dass die Verabreichung von 12-HETE an diabetische Mäuse den Glukosestoffwechsel verbesserte. Die Wirkung von 12-HETE wurde auch ex vivo bestätigt. Darüber hinaus entdeckten sie, dass der molekulare Mechanismus, durch den dieses bioaktive Lipid auf die Kontraktilität des Zwölffingerdarms wirkt, vom Vorhandensein der (durch Enkephalin aktivierten) mu-Opioidrezeptoren (MOR) und PPARγ abhängt. Die präklinischen Ergebnisse wurden durch Humandaten gestützt, die eine Verringerung des 12-HETE-Spiegels und eine geringere Expression von Proenkephalin und MOR im Zwölffingerdarm von Patienten mit Diabetes im Vergleich zu gesunden Probanden zeigten.
Using various approaches with dietary supplements to tackle IBDs, new bioactive lipids with anti-inflammatory properties were identified.172 Exploiting mass spectrometry of the E. coli Nissle 1917 (EcN), a well-studied strain marketed as a probiotic for the treatment of colitis, led to the discovery that the concentration of 3-hydroxyoctadecaenoic acid (C18-3OH) was increased. They found that oral administration of C18-3OH decreased colitis. To determine whether other bacteria present in the gut microbiota produce C18-3OH, the gut microbiota was modulated by using oligofructose. The authors found that the anti-inflammatory properties of oligofructose were associated with an increase in colonic C18-3OH concentration. Finally, they identified specific bacteria producing this bioactive lipid and discovered that C18-3OH acts by activating PPARγ.172
Altogether, these two examples show that the gut microbiota is the source of putative numerous bioactive compounds (figure 2) acting on host receptors involved in the regulation of metabolism and inflammation (figure 3).
Whereas some metabolites are desired for health, others may be harmful, but evidence only derives from association studies or animal testing. Three metabolites with negative impact have been subject to recent studies, including fructoselysine, an advanced glycation end product (AGE), trimethylamine N-oxide (TMAO) and imidazole propionate (IMP).
AGEs are Maillard reaction products formed in our foods by thermal processing when free amino groups of proteins and amino acids react with reducing carbohydrates, forming compounds that are poorly bioavailable. A body of mechanistic evidence has linked AGEs to T2D and CRC through stimulation of the pro-inflammatory response via the activation of the receptor of AGEs,173 174 an increase in gut permeability—allowing closer interaction of AGEs with colonic epithelium—and consequential leakage of bacterial toxins into the systemic circulation.175 Fructoselysine is an Amadori product formed from lysine and glucose that is one of the primary dietary AGEs. Earlier studies showed that E. coli has the capacity to respire fructoselysine.176 However, recent analysis showed that it can be converted into butyrate by members of the genus Intestinimonas spp via a novel pathway.70 Of note, the capability to degrade fructoselysine was experimentally and computationally only observed in formula-fed but not in breast-fed infants, which may relate to high contents of this compound in formulas after thermal treatment.177 Further studies should address the causality of fructoselysine and other AGEs in T2D and other diseases and the involvement of intestinal bacteria in their conversion. A recent study also described the complete utilisation of N-ε-carboxymethyllysine, another major AGE, by Cloacibacillus and potentially Oscillibacter spp.
TMAO hängt mit der Aufnahme von quartären Aminen wie Betain, Cholin und L-Carnitin zusammen, die häufig in Gemüse, Obst, Fleisch und Meeresfrüchten vorkommen und als bakterielle Osmoprotektoren bekannt sind. Mehrere Darmbakterien, darunter mehrere Proteobakterien, können diese quartären Ammoniumionen über TMA-Lyase und ihr aktivierendes Enzym (CutCD) in Acetaldehyd und Trimethylamin (TMA) umwandeln. TMA kann dann in den Blutkreislauf gelangen und wird in der Leber durch Flavin-Monooxygenase in TMAO umgewandelt. Jüngste Studien haben gezeigt, dass TMAO im Serum stark mit Atherosklerose und kardiovaskulären Risiken assoziiert ist. Darüber hinaus hat sich gezeigt, dass TMAO in einem Mausmodell die Bildung atherosklerotischer Plaques fördert. Darüber hinaus ist TMAO ein häufiges urämisches Toxin. Daher besteht ein erhebliches Interesse daran, den Stoffwechsel dieser quaternären Ammoniumionen in Verbindungen zu verstehen, die nicht zu TMA oder anderen TMAO-Vorläufern führen. Neue Erkenntnisse ergaben sich aus der biochemischen Analyse und der Analyse der Stoffwechselwege von Eubacterium limosum und dem verwandten Darmisolat E. maltosivorans, die Betain und andere quaternäre Amine in einem neuartigen Prozess abbauen, an dem bakterielle Zellkompartimente beteiligt sind und der zur Bildung von Acetat und Butyrat führt. Während die letztgenannten Bakterien hochgradig verwandt sind und über einen einzigartigen Vitamin B12-abhängigen Stoffwechselweg zu verfügen scheinen, gilt dies nicht für den Stoffwechsel von Histidin, der zur Bildung von IMP führen kann. Es wurde gezeigt, dass die IMP-Konzentration im Serum von Patienten mit T2D erhöht war. Kürzlich wurde festgestellt, dass IMP aus Histidin von Darmbakterien produziert wird, die die Insulinsignalisierung und die Glukosetoleranz über den vom Mammalian Target of Rapamycin Complex 1 abhängigen Stoffwechselweg beeinträchtigen. Zwei nicht verwandte Bakterien, Streptococcus mutans und Eggerthella lenta, wurden als IMP-Produzenten identifiziert, was die Tatsache bestätigt, dass viele Metaboliten von mehreren Gruppen von Darmbakterien produziert werden, die möglicherweise keine phylogenetischen Beziehungen haben. Insgesamt weisen diese Beispiele darauf hin, dass Darmbakterien an der Entstehung unerwünschter Verbindungen beteiligt sind, dass aber auch neue Anaerobier identifiziert wurden, die diese entgiften und sogar in Produkte wie Butyrat umwandeln können, die ein positives Signalisierungspotenzial haben (Abbildungen 2 und 3).
Allgemeine Schlussfolgerung und Perspektiven
In den letzten zwei Jahrzehnten wurden erhebliche Fortschritte erzielt. Von anfänglichen klinischen Beobachtungen bis hin zu mechanistischeren Ansätzen hat sich der Bereich Darmmikrobiota und Gesundheit zu unwiderlegbaren kausalen Zusammenhängen entwickelt. Allerdings gibt es immer noch zahlreiche Studien, die eine Kausalität behaupten, obwohl in Wirklichkeit nur Korrelationen nachgewiesen werden. Der Übergang von der Korrelation zur Kausalität bleibt ein wichtiger und notwendiger Schritt, um mutmaßliche Interventionen, die auf der Modulation der Darmmikrobiota oder der Verwendung spezifischer Wirkstoffe beruhen, besser zu konzipieren. Dank der zahlreichen Bemühungen und der Fortschritte in der Omics-Analyse bewegt sich die wissenschaftliche Gemeinschaft allmählich in Richtung personalisierte Medizin, und die Mikrobiom-Ära ist eindeutig ein wichtiger Teil des Paradigmenwechsels in der Zukunft der Medizin und der Ernährungsansätze.
Ethische Erklärungen
Patienteneinwilligung zur Veröffentlichung
Nicht zutreffend.
Ethische Genehmigung
An dieser Studie sind keine menschlichen Teilnehmer beteiligt.
Referenzen siehe orignal Review:
vgl. https://gut.bmj.com/content/early/2022/01/31/gutjnl-2021-326789